![]() +7 (920) 230-32-10
+7 (920) 230-32-10
Технология обеззараживания
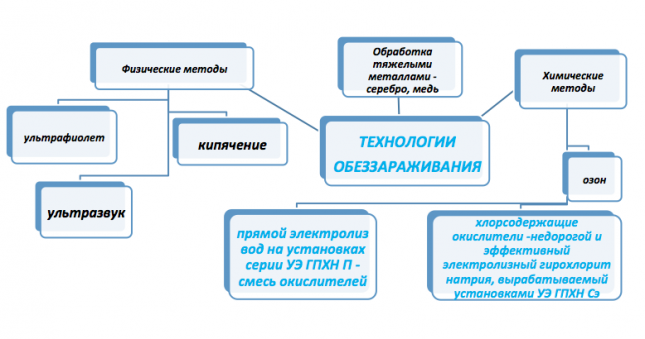
На рисунке выше представлены основные технологии, применяемые для обеззараживания хозяйственно-питьевых вод. Исходя из экономической целесообразности наиболее широкое применение нашли:
- хлорсодержащие вещества,
- ультрафиолет/ультрафиолет+ультразвук.
Ультрафиолет и ультразвук обеззараживают воду\стоки, инактивируя вирусы, грибы, бактерии споры, но не обеспечивают пролонгированного эффекта, создавая опасность для Потребителя вторичного заражения воды. Только присутствие в воде остаточного хлора 0,3-0,5 мг\л гарантируют Потребителю безопасность воды при ее доставке по трубопроводной системе. В добавок ко всему хлорсодержащие вещества обладают сильными окислительными свойствами и способны очистить воду от органики, сероводорода, железа и пр.
Ярким представителем хлосодержащих веществ, широко используемых для обеззараживания, является электролизный гипохлорит натрия, с основным действующим веществом - хлорноватистой кислотой. Он способен очистить и обеззаразить практически любую воду и стоки в соответствии с установленными нормативами, затраты на его производство и сам процесс обеззараживания самые низкие в сравнении со всеми известными методами. Вдобавок ко всему его производство экологически безопасно, безотходно, не требует проектов. Гипохлорит натрия получают методом электролиза солевого раствора под действием электрического тока в специальном аппарате - электролизере. В водных растворах под действием электрического тока происходит диссоциация молекул на ионы и образование новых молекул и связей, происходят следующие реакции:
- Соль и вода распадается на ионы: NaCl + H2O → Na+ +Cl– + Н+ +ОН–
- У анода формируется хлор и соляная кислота: 2Cl– → Cl2+2e– , Cl– + Н+ → НCl, раствор подкисляется
- У катода формируется водород: 2Н+ + 2е→ Н2, гидроокид натрия: Na+ + OH– → NaOH, раствор подщелачивается
- Хлор потребляется для формирования гипохлорита натрия: Cl2 + 2NaOH → H2 + 2NaOCl.
Гипохлорит натрия обладает сильнейшими бактерицидными свойствами: реагирует с белками и нуклеиновыми кислотами;
Гипохлорит натрия обладает сильнейшими окислительными свойствами: реагирует с железом, марганцем, сульфидами, бромидами, цианидами, с аммонием.
дозы хлора для окисления принимаются по СНиП 2.04.02 – 84
двухвалентного железа - 0,7 мгCl2 на 1 мг железа,
марганца - 1,29 мг Cl2 на 1 мг Mn(II),
сульфидов - 2,08 мг Сl2 на 1 мгH2S,
нитритов - 1,54 мг Сl2 на 1 мгNO2– ,
дозы хлора для окисления органических веществ
принимается на основании перманганатной окисляемости по СНиП 2.04.02 – 84 (Приложение 4., табл. 1.).
|
Перманганатная окисляемость воды, мгО2/л |
8 – 10 |
10 – 15 |
15 – 25 |
|
Доза хлора, мг/л |
4 – 8 |
8 – 12 |
12 – 14 |
Имея данные хим-бактериального анализа воды, каждый самостоятельно может произвести расчет требуемого количества хлора на обеззараживание.
Для предварительных расчетов: